
- Författare Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Senast ändrad 2025-01-22 17:10.
Kloret isotop med 18 neutroner har ett överflöd av 0,7577 och ett masstal på 35 amu. För att beräkna genomsnitt atommassa, multiplicera bråkdelen med massatalet för varje isotop , lägg sedan ihop dem.
På samma sätt, vad är det vägda medelvärdet av alla isotoper av ett element?
Att använda massorna av de olika isotoper och hur riklig var och en isotop är, vi kan hitta genomsnitt massan av atomerna i en element . Atommassan för en element är vägt genomsnitt massan av atomerna i ett naturligt förekommande prov av element . Atommassa rapporteras vanligtvis i atommassaenheter.
vad har en massa på 1 amu? En atommassaenhet (symboliserad AMU eller amu) definieras som exakt 1/12 massan av en atom av kol-12. Kol-12 (C-12) atomen har sex protoner och sex neutroner i dess kärna. I oprecisa termer är en AMU genomsnittet av proton vilomassa och den neutron vilomassa.
För det andra, hur beräknar man procentuell mängd med hjälp av atommassa?
Ändra var och en procent överflöd till decimalform genom att dividera med 100. Multiplicera detta värde med atomisk massa av den isotopen. Lägg ihop för varje isotop för att få medelvärdet atomisk massa.
Vad är skillnaden mellan atommassa och atomvikt?
Atomisk massa (ma) är massa av en atom . En enda atom har ett visst antal protoner och neutroner, så massa är otvetydig (kommer inte att förändras) och är summan av antalet protoner och neutroner i atomen . Atomvikt är ett vägt genomsnitt av massa av alla atomer av ett grundämne, baserat på mängden isotoper.
Rekommenderad:
Vad är det geometriska medelvärdet av 4 och 18?

+15. Muxakara och 15 andra lärde sig av detta svar. √(4×18)= √72 eller √36√2= 6√2 förenklat
Hur hittar du det saknade talet när medelvärdet anges?

Medelvärdet av en uppsättning siffror är medelvärdet av dessa siffror. Du kan hitta medelvärdet genom att lägga till uppsättningen siffror och dividera med hur många siffror som ges. Om du får ett medelvärde och ombeds hitta ett nummer som saknas i denna uppsättning, använd en enkel ekvation
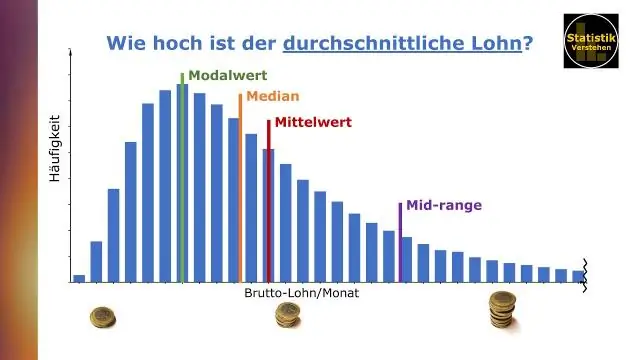
Hur hittar du medelvärdet på en graf?
För att hitta medelvärdet, addera siffrorna och dividera summan med antalet tillägg
Vad är den vägda medelmassan?

Ett grundämnes atommassa är det viktade medelvärdet av massorna av ett grundämnes isotoper. Ett grundämnes atommassa kan beräknas förutsatt att de relativa mängderna av grundämnets naturligt förekommande isotoper och massorna av dessa isotoper är kända
Hur hittar du medelvärdet och medianen i tablå?
Kommunicera data med Tableau av Ben Jones Medelvärdet (eller medelvärdet) bestäms genom att summera alla värden i en datamängd och dividera med antalet värden. Medianen är mittvärdet i en datamängd där värdena har placerats i storleksordning
