
- Författare Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Senast ändrad 2025-01-22 17:10.
Så, vi Beräkna det genom att ta den viktade massa av var och en av isotoperna och addera dem tillsammans. Så, för det första massa , multiplicerar vi 0,50 % av 84 (amu - atomisk massa enheter) = 0,042 amu, och lägg till det till 9,9 % av 86 amu = 8,51 amu, och så vidare.
Därefter kan man också fråga sig hur man beräknar den genomsnittliga atommassan?
Beräknar genomsnittlig atommassa De genomsnittlig atommassa av ett element är summan av massor av dess isotoper, var och en multiplicerad med dess naturliga överflöd (decimalen förknippad med procent av atomer av det elementet som är av en given isotop). Genomsnittlig atommassa = f1M1 + f2M2 +…
Vet också vilka tre typer av information som behövs för att beräkna en genomsnittlig atommassa? Antalet isotoper som finns för elementet. De Atom Nummer för elementet. Den procentuella överflöd av varje isotop.
Man kan också fråga sig vilket värde som ligger närmast strontiums atommassa?
Strontium . I sin rapport från 1961 rekommenderade kommissionen Ar(Sr) = 87,62 baserat på massa -spektrometrisk bestämning av Nier. Detta värde omarbetades till Ar(Sr) = 87,62(1) 1969 och det är oförändrat sedan dess.
Vad har en massa på 1 amu?
En atommassaenhet (symboliserad AMU eller amu) definieras som exakt 1/12 massan av en atom av kol-12. Kol-12 (C-12) atomen har sex protoner och sex neutroner i dess kärna. I oprecisa termer är en AMU genomsnittet av proton vilomassa och den neutron vilomassa.
Rekommenderad:
Hur skiljer sig isotoper från genomsnittliga atomer av samma grundämne?

Isotoper är atomer med samma antal protoner men som har olika antal neutroner. Eftersom atomnumret är lika med antalet protoner och atommassan är summan av protoner och neutroner, kan vi också säga att isotoper är grundämnen med samma atomnummer men olika massnummer
Hur bestäms den genomsnittliga atommassan i det periodiska systemet?

Den genomsnittliga atommassan för ett grundämne beräknas genom att summera massorna av grundämnets isotoper, var och en multiplicerad med dess naturliga förekomst på jorden. När du gör massaberäkningar som involverar grundämnen eller föreningar, använd alltid genomsnittlig atommassa, som finns i det periodiska systemet
Hur hittar du den genomsnittliga fria vägen?

Den genomsnittliga fria vägen är det avstånd som en molekyl färdas mellan kollisioner. Den genomsnittliga fria vägen bestäms av kriteriet att det finns en molekyl i "kollisionsröret" som svepas ut av en molekylär bana. Kriteriet är: λ (N/V) π r2 ≈ 1, där r är radien för en molekyl
Hur beräknar man borets atommassa?
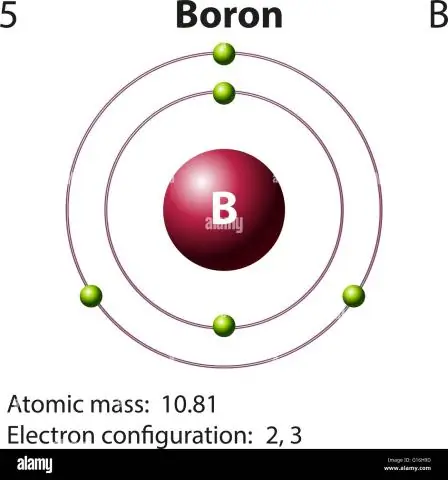
För bor kommer denna ekvation att se ut så här: 5 protoner + 5 neutroner = 10 atommassaenheter (AMU) eller, för den vanligare förekommande borisotopen (ca 5 protoner + 6 neutroner = 11 AMU)
Hur beräknar du övningsproblem för atommassa?

VIDEO Hur löser man då atommassaproblem? Till Beräkna de atomisk massa av en enda atom i ett grundämne, addera massa av protoner och neutroner. Exempel: Hitta atomisk massa av en isotop av kol som har 7 neutroner. Du kan se från det periodiska systemet att kol har en atom - antalet 6, vilket är dess antal protoner.
