- Författare Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Senast ändrad 2025-01-22 17:10.
De vätebindningar i vatten tillåta det absorbera och släpp ut värme energi långsammare än många andra ämnen. Temperatur är ett mått på rörelsen (kinetisk energi ) av molekyler . När rörelsen ökar, energi är högre och därmed är temperaturen högre.
På samma sätt, varför bildas vätebindningar mellan vattenmolekyler?
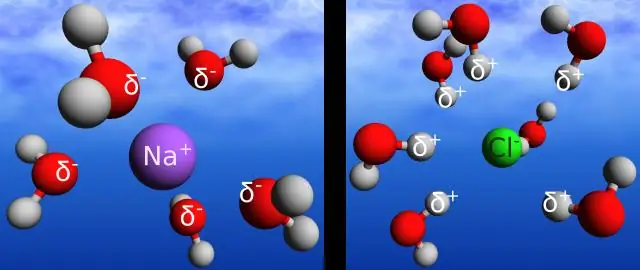
Väte - bindningsformer i vätska vatten som den väte atomer av en vattenmolekyl attraheras mot syreatomen hos en angränsande vattenmolekyl ; i allmänhet en proton som delas av två ensamma elektronpar. Denna attraktion är grunden för ' väte ' obligationer.
Därefter är frågan hur mycket energi som krävs för att bryta bindningarna mellan vattenmolekyler? Genomsnittet bindningsenergi O-H i H2O är 464 kJ/mol. Detta beror på det faktum att H-OH obligation kräver 498,7 kJ/mol för att dissociera, medan O-H obligation behöver 428 kJ/mol. När mer obligation energierna hos obligation likgiltig molekyler tas med i beräkningen, blir genomsnittet mer exakt.
Frågan är också, varför är vatten så effektivt för vätebindning?
Denna attraktion skapad av vätebindning håller vatten i flytande fas över ett brett temperaturområde. Den energi som krävs för att bryta vätebindningar orsaker vatten att ha en hög förångningsvärme så att det krävs en stor mängd energi för att omvandla vätska vatten in i sin gasfas, vatten ånga.
Varför är vätebindningar viktiga i vatten?
Vätebindningar i vatten ge många karakteristiska fördelar till vatten : sammanhållning (hållning vatten molekyler tillsammans), hög specifik värme (absorberar värme när den går sönder, frigör värme vid formning; minimerar temperaturförändringar), hög förångningsvärme (flera vätebindningar måste brytas för att avdunsta vatten )
Rekommenderad:
Hur kan en modell hjälpa till att hitta sannolikheten för en sammansatt händelse?
Definition av sannolikhet för sammansatta händelser En sammansatt händelse är en händelse där det finns mer än ett möjligt utfall. Att bestämma sannolikheten för en sammansatt händelse innebär att hitta summan av sannolikheterna för de enskilda händelserna och, om nödvändigt, ta bort eventuella överlappande sannolikheter
Kan hjälpa till att flytta saker över membranet?

Transportproteinerna som är integrerade i cellmembranet är ofta mycket selektiva när det gäller de kemikalier som de tillåter att passera. Vissa av dessa proteiner kan flytta material över membranet endast när de assisteras av koncentrationsgradienten, en typ av bärarassisterad transport känd som underlättad diffusion
Hur tror du att vattnets sammanhållande natur relaterar till dess avdunstning?

Vattnets sammanhållning Innan det rinner över bildar vattnet en kupolliknande form ovanför glasets kant. Kohesion hänvisar till attraktionen av molekyler för andra molekyler av samma slag, och vattenmolekyler har starka kohesiva krafter tack vare deras förmåga att bilda vätebindningar med varandra
Hur kan jag hjälpa till att stoppa den globala uppvärmningen?

Vill du hjälpa till att stoppa den globala uppvärmningen? Här är 10 enkla saker du kan göra och hur mycket koldioxid du sparar genom att göra dem. Byt ett ljus. Kör mindre. Återvinn mer. Kontrollera dina däck. Använd mindre varmvatten. Undvik produkter med mycket förpackningar. Justera din termostat. Plantera ett träd
Hur kan koordinatplanet hjälpa dig att avgöra att motsvarande sidor är kongruenta?

Med tanke på två trianglar på ett koordinatplan kan du kontrollera om de är kongruenta genom att använda avståndsformeln för att hitta längderna på deras sidor. Om tre par sidor är kongruenta, så är trianglarna kongruenta av ovanstående sats
