
- Författare Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Senast ändrad 2025-01-22 17:10.
Grupp 15: The Kväve familj . De kvävefamiljen inkluderar följande föreningar: kväve (N), fosfor (P), arsenik (As), antimon (Sb) och vismut (Bi). Alla element i grupp 15 har elektronkonfigurationerna2np3 i deras yttre skal, där n är det huvudsakliga kvanttalet.
Också att veta är, vad är familjen eller gruppen av kväve?
Detta grupp är också känd som kvävefamiljen . Den består av elementen kväve (N), fosfor (P), arsenik (As), antimon (Sb), vismut (Bi), och kanske det kemiskt okarakteriserade syntetiska grundämnet moscovium (Mc). I modern IUPAC-notation kallas det Grupp 15.
Förutom ovan, vad är ursprungsnamnet för kväve? Kväve upptäcktes av Daniel Rutherford (GB) 1772. The ursprung av namn kommer från de grekiska orden nitrongener menande nitre och bildande och latinet ord nitrum (nitre är en vanlig namn för kaliumnitrat, KNO3). Det är en färglös, luktfri, generellt inert gas, minimalt reaktiv vid rumstemperatur.
Helt enkelt så, varför finns kväve i grupp 15?
Grupp 15 (VA) innehåller kväve , fosfor, arsenik, antimon och vismut. Element i Grupp15 har fem valenselektroner. Eftersom grundämnena antingen kan få tre elektroner eller förlora fem för att få en stabil konfiguration, bildar de oftare kovalenta föreningar om de inte är bundna till en aktiv metall.
Vem upptäckte kvävefamiljen?
Historik och användningsområden: Kväve var upptäckt av den skotske läkaren Daniel Rutherford 1772. Det är det femte vanligaste grundämnet i universum och utgör cirka 78 % av jordens atmosfär, som uppskattningsvis innehåller 4 000 biljoner ton gas.
Rekommenderad:
Vad är kärnvalenselektronkonfigurationen för kväve?
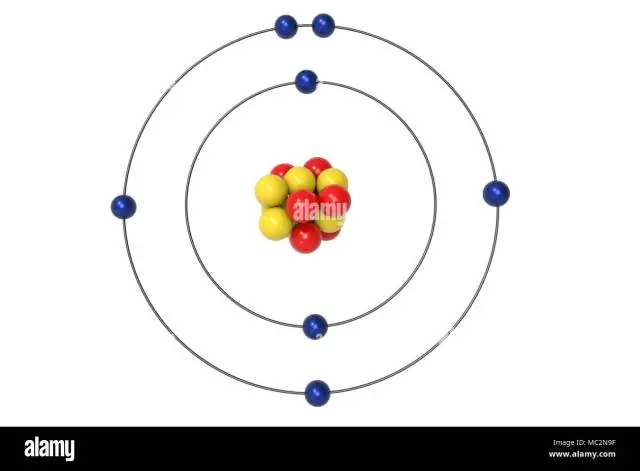
De återstående tre elektronerna kommer att gå i 2p-omloppsbanan. Därför kommer N-elektronkonfigurationen att vara 1s22s22p3. Konfigurationsnotationen för kväve (N) ger ett enkelt sätt för forskare att skriva och kommunicera hur elektroner är ordnade runt kärnan i kväveatomen
Vilket kväve är mest grundläggande?

Kväve 2 är mest grundläggande eftersom det inte finns någon resonans för att binda upp deras elektroner och även 3 R-grupper är elektrondonerande (induktiv effekt). Kväve 3 är minst basisk eftersom det ensamma paret på N är i resonans med C=O
Vilken är den formella laddningen av kväve i denna struktur?

Om vi fortsätter med kvävet, observerar vi att i (a) delar kväveatomen tre bindningspar och har ett ensamt par och har totalt 5 valenselektroner. Den formella laddningen på kväveatomen är därför 5 - (2 + 6/2) = 0. I (b) har kväveatomen en formell laddning på -1
Vilken är den starkaste intermolekylära kraften i kväve?

Förklaring: Den starkaste av de listade svätebindningarna. Denna typ av intermolekylär kraft är den attraktion som sker mellan väteatomer och de ensamma paren onatomer av syre, kväve och/eller fluor. Vätebindningar är starkast medan spridningskrafterna är de svagaste
Vilken av de fyra typerna av organiska molekyler innehåller kväve?

Närvaron av kväve, syre och andra atomer ger variation till dessa kolmolekyler. Fyra viktiga klasser av organiska molekyler – kolhydrater, lipider, proteiner och nukleinsyror – diskuteras i följande avsnitt
