
- Författare Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Senast ändrad 2025-01-22 17:10.
I den Bohr modell , behandlas elektronen som apartikel i fasta banor runt kärnan. Schrödingers modell (Quantum Mechanical Modell ) tillät elektronen att uppta tredimensionellt utrymme. Det krävdes därför tre koordinater, eller tre kvanttal, för att beskriva fördelningen av elektroner i atomen.
På samma sätt kan man fråga sig, hur skiljer sig Schrödingers modell från Bohrs frågesport?
Bohrs modell visar elektronerna som rör sig runt kärnan som cirkulära "banor". Schrödingers modell visar elektronerna som rör sig runt kärnan i vågliknande rörelser som kallas "orbitaler". Annorlunda atomer har annorlunda elektronkonfigurationer, så de avger en annorlunda spektra av ljus.
På samma sätt, vad är Schrödinger-modellen? En kraftfull modell av atomen utvecklades av Erwin Schrödinger år 1926. Den Schrödingermodell antar att elektronen är en våg och försöker beskriva de regioner i rymden, eller orbitaler, där elektroner med största sannolikhet finns.
Helt enkelt så, hur ändrade Schrodinger Bohrs modell?
I den Bohr modell , elektronerna är partiklar som endast upptar vissa banor av fast energi runt kärnan. Schrödinger modell , elektronerna beter sig stående vågor som har större sannolikhet att vara i vissa regioner av rymden (orbitaler) än i andra.
Vad är likheten och skillnaden mellan Bohr-modell och kvantmekanisk modell?
De Bohr modell behandlar elektronerna med samma värde som degenererade, det vill säga har samma energi. Positioner ockuperade av elektroner: De viktigaste likhet mellan de två modeller är att i båda elektronerna är annorlunda avstånd från kärnan, motsvarande annorlunda energier.
Rekommenderad:
Hur skiljer sig toleiitisk basalt från de flesta vulkaniska bergarter?

Bergarter i den tholeiitiska magmaserien klassificeras som subalkaliska (de innehåller mindre natrium än vissa andra basalter) och särskiljs från bergarter i den calc-alkaliska magmaserien genom redoxtillståndet hos den magma de kristalliserade från (tholeiitiska magma reduceras; calc- alkaliska magma oxideras)
Hur skiljer sig ofullständig dominans och samdominans från ett normalt mendelskt kors?

Vid både samdominans och ofullständig dominans är båda allelerna för en egenskap dominanta. Vid samdominans uttrycker en heterozygot individ båda samtidigt utan någon blandning. I ofullständig dominans blandar en heterozygot individ de två egenskaperna
Hur skiljer sig en kovalent bindning från en jonbindningsquizlet?

Skillnaden mellan en jonisk och en kovalent bindning är att en kovalent bindning bildas när två atomer delar elektroner. Jonbindningar är krafter som håller samman elektrostatiska krafter av attraktioner mellan motsatt laddade joner. Jonbindningar har en elektronegativitetsskillnad som är större än eller lika med 2
Hur skiljer sig formen på en växtcell från en djurcells form?
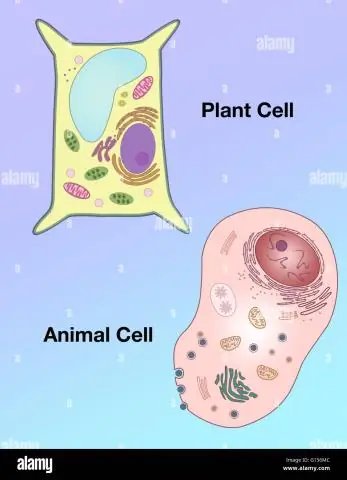
Vakuoler: Växtceller har en stor vakuol, medan djurceller innehåller flera små vakuoler. Form: Växtceller har en mer regelbunden form (vanligen rektangulär), medan djurceller har oregelbundna former. Lysosomer: finns vanligtvis i djurceller, medan de saknas i växtceller
Hur skiljer sig isotoper från genomsnittliga atomer av samma grundämne?

Isotoper är atomer med samma antal protoner men som har olika antal neutroner. Eftersom atomnumret är lika med antalet protoner och atommassan är summan av protoner och neutroner, kan vi också säga att isotoper är grundämnen med samma atomnummer men olika massnummer
