
Innehållsförteckning:
- Författare Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:40.
- Senast ändrad 2025-01-22 17:10.
Buffert
- Om du bara har en svag syra . Bestäm koncentrationen av syra (förutsatt att det inte finns någon dissociation). Slå upp eller bestäm Ka.
- Om du har en svag syra OCH konjugatet bas . Lösa för bufferten.
- Om du bara har konjugatet bas . Lösa för pH i bas använder Kb och hydrolysekvationen.
Följaktligen, hur gör man syrabastitrering?
Titreringsförfarande
- Skölj byretten med standardlösningen, pipetten med den okända lösningen och den koniska kolven med destillerat vatten.
- Placera en noggrant uppmätt volym av analyten i Erlenmeyer-kolven med hjälp av pipetten, tillsammans med några droppar indikator.
Likaså, hur beräknar man titrering? Använd titreringsformel . Om titranten och analyten har ett molförhållande på 1:1, formel är molaritet (M) av syran x volym (V) av syran = molaritet (M) av basen x volym (V) av basen. ( Molaritet är koncentration av en lösning uttryckt som antalet mol löst ämne per liter lösning.)
Är dessutom en stark eller svag bas?
därför jag- är mest stabil, och minst grundläggande, medan F - är minst stabil och mest grundläggande. Starka baser interagera helt med stark syror som HCl för att bilda ett salt och vatten i en neutralisationsreaktion. Övrig starka baser är lösliga oxider, som Na2O och lösliga hydroxidsalter. Starka baser är stark elektrolyter.
Vad används titrering till?
A titrering är en teknik där en lösning med känd koncentration är brukade bestämma koncentrationen av en okänd lösning. Typiskt tillsätts titranten (den kända lösningen) från en byrett till en känd kvantitet av analyten (den okända lösningen) tills reaktionen är fullständig.
Rekommenderad:
Vilka är stegen för att rita en funktion?
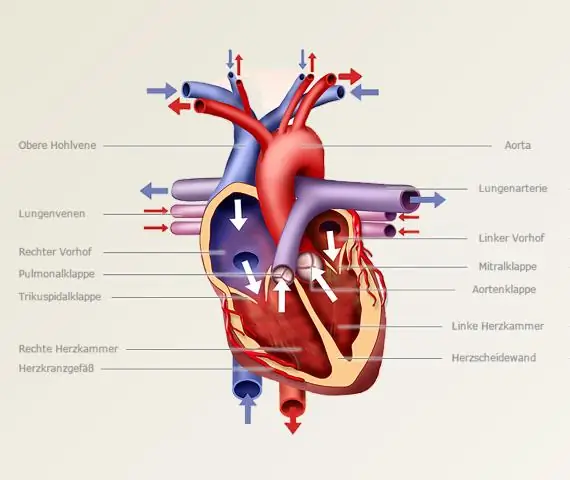
Steg för att skissa grafen för funktionen Bestäm om funktionen erhålls genom att transformera en enklare funktion och utför nödvändiga steg för denna enklare funktion. Bestäm om funktionen är jämn, udda eller periodisk. Hitta y-skärningspunkten (punkt). Hitta x-skärningar (punkter där). Ta reda på vilka asymptoter funktion har, om några
Vilka är stegen för att lösa ordproblem?
Enkla steg för att lösa Word-problem Läs problemet. Börja med att läsa problemet noggrant. Identifiera och lista fakta. Ta reda på exakt vad problemet efterfrågar. Eliminera överflödig information. Var uppmärksam på måttenheter. Rita ett diagram. Hitta eller utveckla en formel. Konsultera en referens
Vilka är stegen för att lösa tvåstegsskillnader?

Det krävs två steg för att lösa en ekvation eller olikhet som har mer än en operation: Förenkla med inversen av addition eller subtraktion. Förenkla ytterligare genom att använda inversen av multiplikation eller division
Vilka är stegen för att separera sand och vatten?

När sand tillsätts vatten hänger den antingen i vattnet eller bildar ett lager i botten av behållaren. Sand löser sig därför inte i vatten och är olöslig. Det är lätt att separera sand och vatten genom att filtrera blandningen. Salt kan separeras från en lösning genom avdunstning
Vilka är stegen för att lösa en ekvation?

För att lösa en tvåstegs algebraisk ekvation är allt du behöver göra att isolera variabeln genom att använda antingen addition, subtraktion, multiplikation eller division. Lös en tvåstegsekvation genom att multiplicera i slutet istället för att dividera. x/5 + 7 = -3 = (x/5 + 7) - 7 = -3 - 7 = x/5 = -10. x/5 * 5 = -10 * 5. x = -50
