
- Författare Miles Stephen [email protected].
- Public 2023-12-15 23:40.
- Senast ändrad 2025-06-01 05:06.
två
Härav, vilka element är undantag från Aufbau-principen?
Till exempel rutenium, rodium, silver och platina är alla undantag från Aufbau-principen på grund av fyllda eller halvfyllda underskal.
Förutom ovan, varför är elektronkonfigurationen för koppar 1s22s22p63s23p63d104s1 istället för 1s22s22p63s23p63d94s2? En fylld undernivå är mer stabil än en halvfylld undernivå. Arrangemanget av elektroner med samma snurr är så liten som möjligt. 4s orbitalen har högre energi än 3d orbitalen.
Frågade också, hur skriver man elektronkonfigurationen för D-blockelement?
I allmänhet elektronisk konfiguration av dessa element är (n-1) d 1-10ns 1-2. (n-1) finns kvar för det inåtvända d orbitaler som kan ha en till tio elektroner och den perifera ns orbitalen kan ha en eller två elektroner. De d - blockera involverar mittområdet flankerat av s- och p- block i det periodiska systemet.
Varför visar Cr och Cu oregelbunden konfiguration?
Samma händer med Cu . Vi burk se det i Cu d subshell har 9 elektroner så för att bli stabilt behöver det ytterligare 1 elektron i d subshell så det tar 1 elektron från s subshell och nu Cu kommer att bli stabil i sin nya elektroniska konfiguration . Därav, Cr och Cu är kallas exceptionell konfiguration.
Rekommenderad:
Hur många EcoRI-ställen finns det i lambda-DNA?
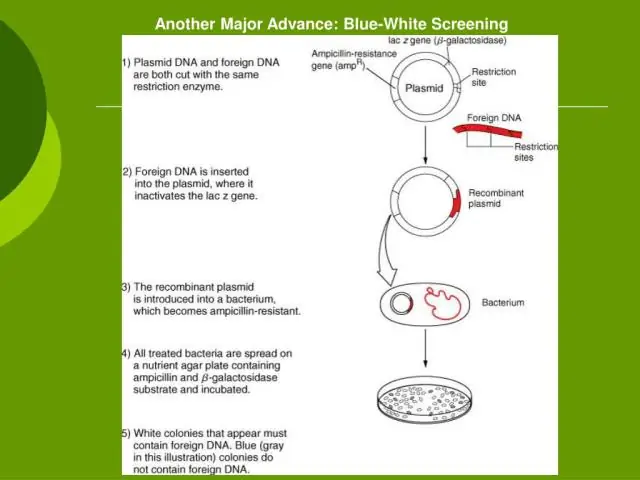
Lambda-DNA som används i detta experiment isoleras som en linjär molekyl från E. coli-bakteriofagen lambda. Den innehåller cirka 49 000 baspar och har 5 igenkänningsställen för Eco RI och 7 för Hind III
Hur många kärnor finns det i en kärna?

Fördelningen av antalet nukleoler i många diploida celler uppvisade ett sätt på två eller tre nukleoler per kärna och ett intervall från 1 till 6 nukleoler
Hur många konstgjorda grundämnen finns det i det periodiska systemet?

De syntetiska grundämnena är de med atomnummer 95–118, som visas i lila på det medföljande periodiska systemet: dessa 24 grundämnen skapades först mellan 1944 och 2010
Vad är en autosom och hur många finns det i det mänskliga genomet?

DNA i autosomer är gemensamt känt som atDNA eller auDNA. Till exempel har människor ett diploid genom som vanligtvis innehåller 22 par autosomer och ett allosompar (totalt 46 kromosomer)
Hur många grundämnen finns det på det periodiska diagrammet?

Elementen i det periodiska systemet sorterade efter atomnummer. klicka på ett elements namn för ytterligare kemiska egenskaper, miljödata eller hälsoeffekter. Denna lista innehåller kemins 118 element. För kemistudenter och lärare: Tabelldiagrammet till höger är ordnat efter atomnummer
