
- Författare Miles Stephen [email protected].
- Public 2023-12-15 23:40.
- Senast ändrad 2025-01-22 17:10.
Varje element utsläpp spektrum är distinkt eftersom varje element har en annorlunda uppsättning elektronenerginivåer. Utsläppet rader motsvarar skillnaderna mellan olika par av de många energinivåerna. De rader (fotoner) emitteras när elektroner faller från orbitaler med högre energi till lägre energier.
Dessutom, varför producerar olika element olika antal spektrallinjer?
Frekvenserna är karakteristiska för egenskaperna hos kärnan och den tal av elektroner fördelade mellan olika "skal." Enligt kvantmekaniken finns det ett maximum antal elektroner tillåtna i varje bundet skal. Det här är varför olika element har olika diskreta emissionsfrekvenser.
För det andra, varför är vissa spektrallinjer ljusare än andra? I väte spektrum , några spektrallinjer är ljusare än andra beroende på deras energinivå. Dessa ljusa linjer visa att elektroner har hoppat från högre energinivå till lägre energinivå. Alltså i väte spektrum vissa linjer är ljusare än andra.
I detta avseende, vad representerar de olika färgerna i ett linjespektrum Varför är spektra för varje element unika?
Varje element har sin egen unikt linjespektrum och kallas därför för "fingeravtrycket" för en viss element . De spektra för varje element är unik eftersom varje element innehåller olika antal elektroner och därmed annorlunda energinivåer.
Varför avger varje element en annan färg?
Uppvärmning ett atomen exciterar sina elektroner och de hoppar till högre energinivåer. När elektronerna återgår till lägre energinivåer kommer de avge energi i form av ljus. Varje element har a annorlunda antal elektroner och a annorlunda uppsättning energinivåer. Således, varje element avger sin egen uppsättning färger.
Rekommenderad:
Varför ser färger olika ut i olika belysning?

Objekt ser olika ut eftersom de absorberar vissa färger (våglängder) och reflekteras eller överför andra färger. Till exempel ser en röd skjorta röd ut eftersom färgämnesmolekylerna i tyget har absorberat ljusets våglängder från den violetta/blåa änden av spektrat
Varför har olika träd olika löv?

Om ett träd har större löv har löven problem med att rivas i vindar. Dessa blad skapar snitt i sig själva så att luft går igenom bladet smidigt utan att gå sönder. Ett blad kan ha en annan form eftersom ett blad måste få solljus och koldioxid för fotosyntes
Varför är absorptionsspektrumet för klorofyll a och verkansspektrumet för fotosyntes olika?
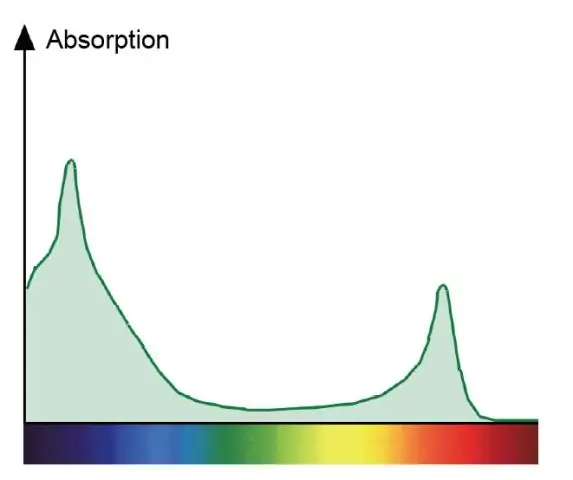
Ett absorptionsspektrum visar alla ljusfärger som absorberas av en växt. Ett aktionsspektrum visar alla ljusets färger som används i fotosyntesen. Klorofyller är de gröna pigmenten som absorberar rött och blått och deltar direkt i fotosyntesen
Vad måste hända med elektroner för att producera spektrallinjer?

När elektroner rör sig från en högre energinivå till en lägre emitteras fotoner, och en emissionslinje kan ses i spektrumet. Absorptionslinjer ses när elektroner absorberar fotoner och flyttar till högre energinivåer. Om en atom har förlorat en eller flera elektroner kallas den för en jon och sägs vara joniserad
Vad är olika för varje nukleotid?

Nukleotider i DNA innehåller fyra olika kvävebaser: tymin, cytosin, adenin eller guanin. Det finns två grupper av baser: Pyrimidiner: Cytosin och tymin har vardera en enda sex-ledad ring
