
Innehållsförteckning:
- Författare Miles Stephen [email protected].
- Public 2024-01-18 08:19.
- Senast ändrad 2025-01-22 17:10.
Ideal Gas Law Formel
- Ideal gaslag Formelfrågor:
- Svar: Volymen är V = 890,0mL och temperaturen är T = 21°C och trycket är P = 750mmHg.
- PV = nRT.
- Svar: Antalet mol är n = 3,00 mol, temperaturen är T = 24°C och trycket är P = 762,4 mmHg.
- PV = nRT.
Utöver detta, hur beräknar du idealgaslagen?
Egenskaperna för en idealgas är alla fodrade i en formel av formen pV = nRT, där:
- p är gasens tryck, mätt i Pa,
- V är volymen av gasen, mätt i m^3,
- n är mängden ämne, mätt i mol,
- R är den ideala gaskonstanten och.
- T är gasens temperatur, mätt i Kelvin.
På samma sätt, varför är lagen om idealgas viktig? Boyles Lag anger att, när temperaturen är konstant, trycket och volymen av ett fast prov av a gas är omvänt proportionella (P1 x V1 = P2 x V2). Så betydelsen är att idealgaslagen beräknar beteendet hos någon gas under vanliga temperatur- och tryckförhållanden.
Frågan är också, hur hittar man tryck med hjälp av idealgaslagen?
Låt oss först se över idealgaslagen PV = nRT. I denna ekvation är 'P' tryck i atmosfärer är 'V' volymen i liter, 'n' är antalet partiklar i mol, 'T' är temperaturen i Kelvin och 'R' är idealisk gas konstant (0,0821 liter atmosfärer per mol Kelvin).
Vilka är enheterna för idealgaslag?
I SI-enheter mäts p i pascals , V mäts i kubikmeter, n mäts i mol och T in kelvins (de Kelvin skalan är en förskjuten Celsius skala, där 0,00 K = −273,15 °C, lägsta möjliga temperatur). R har värdet 8,314 J/(K. mol) ≈ 2 cal/(K.
Rekommenderad:
Hur löser man en andragradsekvation med hjälp av nollfaktorlagen?

Av detta kan vi dra slutsatsen att: Om produkten av två siffror är noll, så är ett eller båda talen noll. Det vill säga, om ab = 0, så är a = 0 eller b = 0 (vilket inkluderar möjligheten att a = b = 0). Detta kallas nollfaktorlagen; och vi använder det ofta för att lösa andragradsekvationer
Hur löser man tvåstegsekvationer i prealgebra?

VIDEO På samma sätt, vilka är de fyra stegen för att lösa en ekvation? En 4-stegsguide för att lösa ekvationer (del 2) Steg 1: Förenkla varje sida av ekvationen. Som vi lärde oss förra gången är det första steget för att lösa en ekvation att göra ekvationen så enkel som möjligt.
Hur löser man multiplicera och dividera bråk?
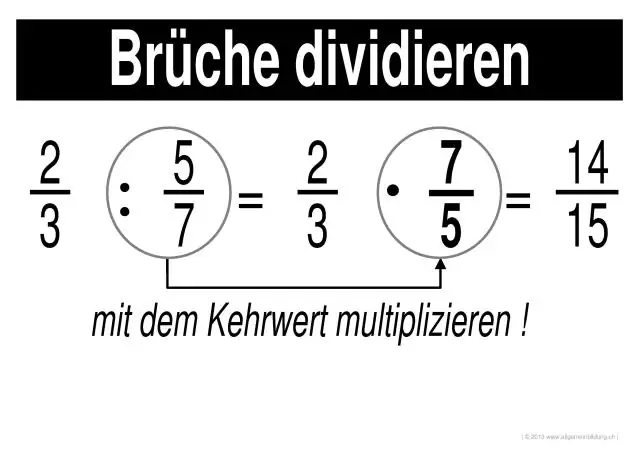
Multiplicera och dividera bråk Steg 1: Multiplicera täljarna från varje bråk med varandra (talen överst). Resultatet är täljaren för svaret. Steg 2: Multiplicera nämnarna för varje bråkdel med varandra (siffrorna på botten). Resultatet är nämnaren för svaret. Steg 3: Förenkla eller förminska svaret
Hur löser man en exponentregel?
Flytta bara de negativa exponenterna. Produktregel: am ∙ an = am + n, detta säger att för att multiplicera två exponenter med samma bas, behåller du basen och adderar potenserna., detta säger att för att dividera två exponenter med samma bas, behåller du basen och subtrahera krafterna
Hur löser man ett system av linjära ekvationer grafiskt?

För att lösa ett system av linjära ekvationer grafiskt ritar vi båda ekvationerna i samma koordinatsystem. Lösningen till systemet kommer att vara i den punkt där de två linjerna skär varandra. De två linjerna skär varandra i (-3, -4) vilket är lösningen på detta ekvationssystem
