
- Författare Miles Stephen [email protected].
- Public 2023-12-15 23:41.
- Senast ändrad 2025-01-22 17:11.
Låt oss ta ett exempel på en buffert består av den svaga basen ammoniak , NH3 och dess konjugerade syra, NH4+. När HCl (stark syra) tillsätts till detta buffert systemet förbrukas de extra H+-jonerna som läggs till systemet av NH3 till form NH4+. Den ytterligare tillsatsen av en syra eller bas till buffert kommer att ändra pH snabbt.
På samma sätt, är nh3 och NH4Cl en buffertlösning?
Svar och förklaring: Ammoniak och ammoniumklorid buffert är en blandning av svag syra och dess salt. Det är en grundläggande buffert eftersom basdissociationskonstanten för ammoniak är större än syrakonstanten för ammoniumjoner.
På samma sätt, vilken typ av reaktion är HCl och nh3? Således NH3 vid mottagande av H+ av HCl (H+ och Cl-) bildar NH4+ (ammoniumjon) som vid bindning med Cl- jon (från HCl (Na2S04) ger NH4Cl (ammoniumklorid). De reaktion representeras som NH3 + HCl = NH4Cl.
Frågan är också, vilken reaktion sker när HCl tillsätts till ammoniakbuffert?
Den saltsyra syra skulle reagera häftigt med ammoniaken för att bilda ammoniumklorid (som är ett mycket svagt surt salt, i allmänhet ofarligt), vilket neutraliserar lösningens basicitet och kraftig bildning av vätgasbubblor skulle observeras, som brusande av lösningen.
Hur gör man en ammoniakbuffertlösning?
Ammoniak -Ammoniumklorid Buffert : Lös 67,5 g ammoniumklorid i ca 200 ml vatten, tillsätt 570 ml stark ammoniaklösning och späd med vatten till 1000 ml. Ammoniakbuffert pH 9,5: Lös 33,5 g ammoniumklorid i ISO ml vatten och 42 ml 10M ammoniak och späd med vatten till 250 ml.
Rekommenderad:
Vilken lösning är en buffert?

En buffertlösning är en lösning som motstår förändringar i pH när små mängder av en syra eller alkali tillsätts. Sura buffertlösningar. En sur buffertlösning är helt enkelt en som har ett pH lägre än 7. Sura buffertlösningar görs vanligtvis av en svag syra och ett av dess salter - ofta ett natriumsalt
Varför fungerar en buffert bäst vid ett pH nära dess pKa?
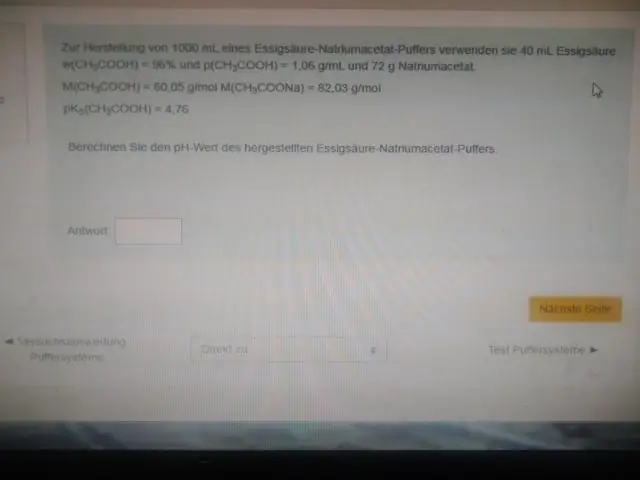
Med andra ord är pH för den ekvimolära lösningen av syra (t.ex. när förhållandet mellan koncentrationen av syra och konjugatbas är 1:1) lika med pKa. Denna region är den mest effektiva för att motstå stora förändringar i pH när antingen syra eller bas tillsätts. En titreringskurva visar visuellt buffertkapaciteten
Varför paras A och T och G och C i en DNA-dubbelhelix?

Detta innebär att var och en av de två strängarna i dubbelsträngat DNA fungerar som en mall för att producera två nya strängar. Replikation bygger på komplementär basparning, det är principen som förklaras av Chargaffs regler: adenin (A) binder alltid med tymin(T) och cytosin (C) binder alltid med guanin(G)
Kan en stark syra och svag bas bilda en buffert?

Som du har sett vid beräkning av lösningars pH-värde är endast en liten mängd av en stark syra nödvändig för att drastiskt ändra pH. En buffert är helt enkelt en blandning av en svag syra och dess konjugerade bas eller en svag bas och dess konjugerade syra. Buffertar fungerar genom att reagera med eventuell tillsatt syra eller bas för att kontrollera pH
Vilken funktion har PCR-buffert?

Ursprungligen besvarade: Vilken roll har en buffert i en PCR? Vanligtvis är en buffert en lösning som kan motstå pH-förändringar genom att kemiskt neutralisera små mängder tillsatta sura eller basiska föreningar, och på så sätt bibehålla det totala pH-värdet i ett medium. Varför är detta nödvändigt för PCR? DNA är pH-känsligt
